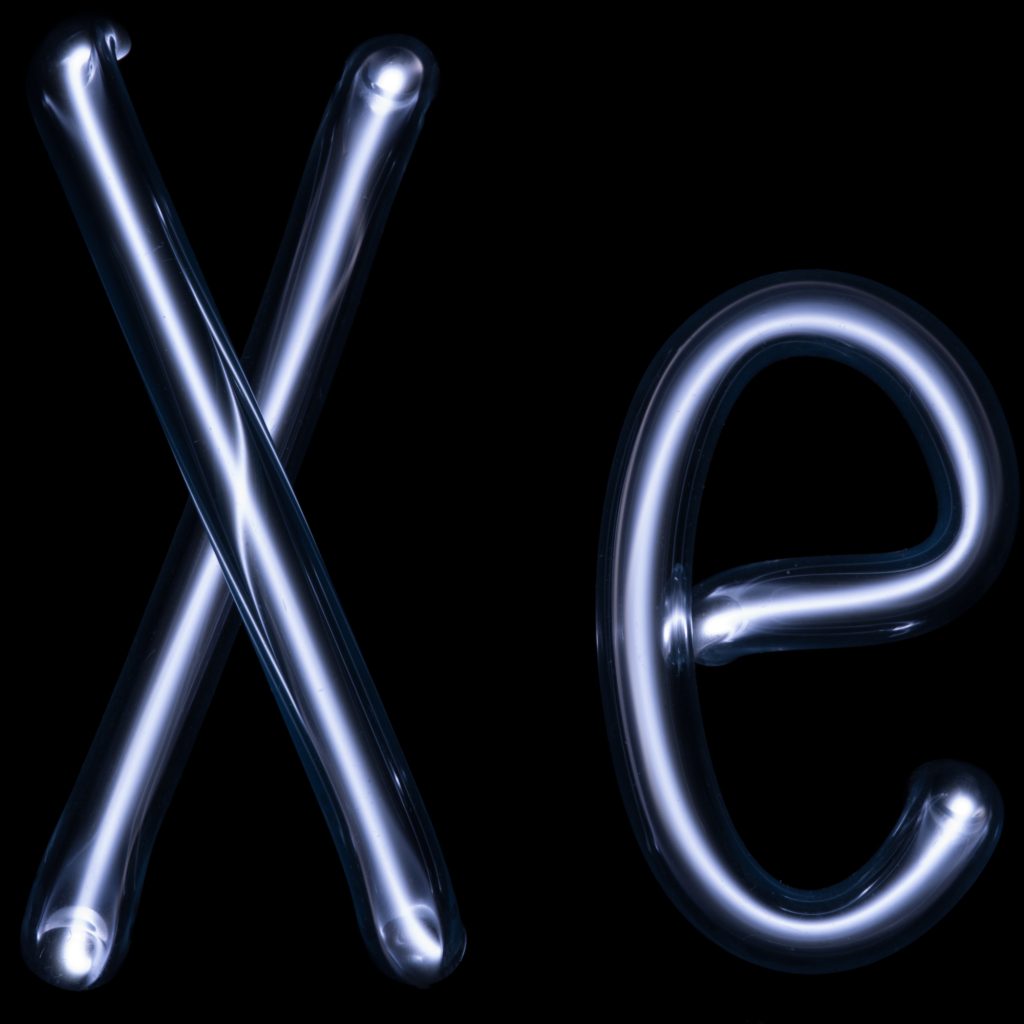Cómo funcionan las luces de neón
Brillan y dan color. Fueron la furia de la publicidad en el pasado siglo pero, además, son un hito en la historia de la química. ¿Te has preguntado alguna vez cómo funcionan las luces de neón?
Los gases inertes como el helio, el neón o el argón no tienden a formar moléculas estables al enlazarse con otros átomos. Sin embargo, un pequeño voltaje puede hacer que se iluminen, una propiedad que fue astutamente explotada por el químico Georges Claude, apodado “el Edison francés”, que hizo su fortuna con las luces de neón a principios del siglo XX.
Algunos años antes, en 1898, William Ramsay y Morris Travers separaron el gas neón puro del aire. Este “nuevo gas”, que es lo que significa su nombre, encajaba estupendamente en el hueco que había dejado para él en la tabla periódica el bueno de Mendeléyev y se trataba de un gas noble. Así que el neón, en un principio, se limitó a iluminar los laboratorios de los físicos, que empezaron a estudiar sus propiedades en los tubos de descarga de gases a baja presión que se utilizaban en la época.
Mientras tanto, George Claude fundaba su empresa para licuar aire, Air Liquide, y empezó a producir toneladas de gas neón purificado. Si el neón era bueno para iluminar, ¿por qué no inventar una lámpara que aprovechase todo su potencial? Claude patentó tubos de luz de gas de hasta 30 metros de largo que podían contener, además de neón, otros gases como el helio, el argón y vapor de mercurio para crear diferentes colores.

En 1912, un barbero de París compraba el primer cartel comercial de neón a Claude. Durante las siguientes décadas, el químico francés introdujo su invento en Estados Unidos de América, donde se convirtió en una forma de publicidad tan popular que acabó por tener una gran influencia en el estilo art decó de la época y pasó a ser un movimiento artístico con nombre propio en la década de 1950.
¿Cómo funciona una luz de neón?
Una lámpara de neón es un tubo de vidrio sellado lleno de gas neón, que es uno de los llamados gases “nobles” (inertes o no reactivos) representados en el extremo derecho de la tabla periódica. Hay cantidades diminutas de neón en el aire que nos rodea. De hecho, si tomas una bocanada grande de aire, estarás respirando un volumen de neón tan grande como una pepita de limón. En la lámpara de neón, hay terminales eléctricos en cada extremo del tubo, a un lado el terminal negativo y, en el otro, un terminal positivo.
Cuando el tubo está apagado, el tubo contiene átomos ordinarios de gas neón. Pero, cuando los terminales se conectan a una fuente de alimentación de alto voltaje (alrededor de 15,000 voltios, porque necesita mucha “fuerza eléctrica” para que las cosas sucedan) y la lámpara se enciende, los átomos de neón empezarán a separarse. Algunos de los átomos perderán electrones para convertirse en iones cargados positivamente. Al estar cargados positivamente, estos iones de neón tenderán a moverse hacia la terminal eléctrica negativa. Los electrones que pierden los átomos de neón tienen carga negativa, por lo que se precipitan en dirección opuesta hacia el terminal positivo en el otro extremo del tubo. En todo este ajetreo, los átomos, los iones y los electrones chocan constantemente entre sí. Esas colisiones generan un choque repentino de energía que excita los átomos e iones y los hace emitir fotones de luz roja.
Estas colisiones ocurren con tal rapidez que se obtiene un flujo constante de luz roja en el tubo. También, una gran cantidad de energía emitida en forma de calor. Los tubos de neón se calientan mucho porque los átomos emiten bastante radiación infrarroja invisible (es decir, calor), así como radiación visible (luz roja).
Esto es lo que sucede, groso modo, en una lámpara de neón. ¿Por qué no ocurre lo mismo con otros gases? En términos generales, cuando dos átomos se acercan, los orbitales de mayor energía o valencia de los átomos cambian sustancialmente y los electrones de los dos átomos se reorganizan. Si esta reorganización reduce la energía total de los electrones involucrados, se puede formar un enlace químico. Para los átomos ordinarios, no inertes, los electrones son relativamente flexibles y a menudo se forman enlaces. Sin embargo, los electrones de los gases inertes son relativamente resistentes a este efecto de proximidad, por lo que estos gases rara vez se unen para formar moléculas.
Como explica el profesor de física Eric Schiff, la aparente contradicción entre la inercia de un gas (con respecto al enlace químico) y su vivacidad (en una descarga luminiscente) es un ejemplo de un fenómeno más amplio que podríamos llamar “la insoportable inercia de la materia”. Un átomo puede considerarse una partícula inerte y no reactiva siempre que la energía de su interacción con otras partículas (incluidos los fotones) sea lo suficientemente pequeña como para que los electrones del átomo no se exciten. Los átomos de gases inertes como el neón son los más relajados. Aún así, a medida que aumentan las energías de interacción, incluso ellas pierden su inercia, y finalmente obtenemos una sopa de núcleos inertes y plasma altamente excitado de electrones. Aumenta más la energía (en realidad, mucho más), y los núcleos tampoco son tan inertes. En cambio, se obtiene un brebaje de núcleos como los que se encuentran en una estrella de neutrones. Aumenta un poco más la energía y entramos en el reino de los quarks. Aquí, incluso los nucleones ya no son inertes y hemos vuelto a las condiciones primordiales increíblemente energéticas que prevalecieron poco después del Big Bang.
¿Cómo se hacen tubos de neón de colores?
Los niveles de energía dentro de los átomos son como los peldaños de una escalera: los electrones solo pueden estar en los peldaños, no en los espacios intermedios. Eso significa que los átomos pueden absorber o liberar energía solo en paquetes de tamaño fijo (llamados ‘cuantos’) y los átomos de diferentes elementos químicos darán cuantos que son más grandes o más pequeños, dependiendo de su estructura interna. Los átomos que emiten cantidades más grandes de energía producen luz de mayor frecuencia (más azul) que los átomos que emiten cantidades más pequeñas. En el neón, los cuantos de energía que se emiten se corresponden exactamente con la luz que vemos como roja. Otros gases nobles emiten luz de diferentes colores. El argón, por ejemplo, produce luz azul, por lo que cuando ves lámparas de “neón” que brillan en azul, en realidad estás mirando tubos llenos de argón, no de neón. Hay dos formas de hacer otros colores. Puede poner más de un gas en el mismo tubo de “neón”. Para hacer tubos verdes, necesitas neón y argón juntos. Para el violeta, usarías argón y xenón. También, se puede cambiar el color de la luz pintando las paredes del tubo con fósforos de diferentes colores. Por ejemplo, pintar con un fósforo azul en un tubo de neón rojo para hacer una luz rosa, o un fósforo verde con neón rojo para hacer una luz naranja…