Dmitri Mendeleev y la piedra Rosetta de los electrones
Cuando los elementos se ordenan según su peso atómico, muestran una periodicidad evidente en sus propiedades.
Esta es la Ley periódica de Mendeleev, que describe la manera en que se organizan los elementos químicos en la tabla que lleva su nombre. El catálogo definitivo de los tipos de átomos. Dmitri Mendeleev publicó su tabla periódica en 1869, ubicando los elementos en grupos (columnas) y periodos (filas) que comparten ciertas propiedades. En cierto sentido, la ley de Mendeleev acabó con el aspecto más mágico de la química. Hasta el momento de su publicación, cada nuevo elemento era descubierto por sorpresa. Para los pre-químicos, los alquimistas, la máxima aspiración era conseguir la piedra filosofal, un compuesto capaz de “flogistar” -de convertir cualquier elemento en oro-, de otorgar la vida eterna y toda clase de proezas mágicas. Para la ciencia, la tabla periódica sería más bien una piedra de Rosetta que -con el tiempo- ayudaría a descifrar la estructura atómica de todos los elementos existentes en el universo.
La Ley periódica no es estricta -su propio autor identificó varias excepciones– pero es un sistema de orden fiable. Tanto que, aunque en el momento de publicación de la tabla sólo se conocían 63 elementos, Mendeleev sabía que faltaban muchos por descubrir porque su sistema necesitaba de “huecos” entre unos elementos y otros para tener sentido. Si bien no podía identificar qué debía ir justo debajo del aluminio, porque a ningún elemento conocido le correspondía una masa atómica de 68 gramos por mol, podía predecir que ese elemento sería un metal muy maleable con baja temperatura de fusión, y que un centímetro cúbico de dicha sustancia pesaría unos seis gramos. Seis años después, Lecoq descubrió el galio, el elemento que había de ocupar este hueco y que -por supuesto- cumplía todas las características atribuidas al hipotético elemento 31 de la tabla periódica.
La tabla periódica sigue teniendo un enorme valor como instrumento científico y docente, pero en el momento de su publicación fue una guía para comprender cosas que no serían descubiertas hasta años más tarde. Por ejemplo, los electrones.
Resulta que la tabla periódica es la chuleta definitiva para conocer la configuración electrónica de los elementos o cómo se organizan las cargas de un átomo alrededor del núcleo. Los átomos utilizan los electrones para participar en reacciones químicas. Así, conocer la distribución de sus electrones permite predecir su reactividad, su capacidad para interactuar con átomos de otros elementos. Aunque a finales del siglo XIX no se conocía la estructura atómica, la observación del comportamiento de los elementos conocidos y la predicción de que entre ellos debía haber por fuerza otros todavía no identificados permitió al obstinado Mendeleev dar con un método para ordenar los elementos químicos que todavía utilizamos hoy en día:
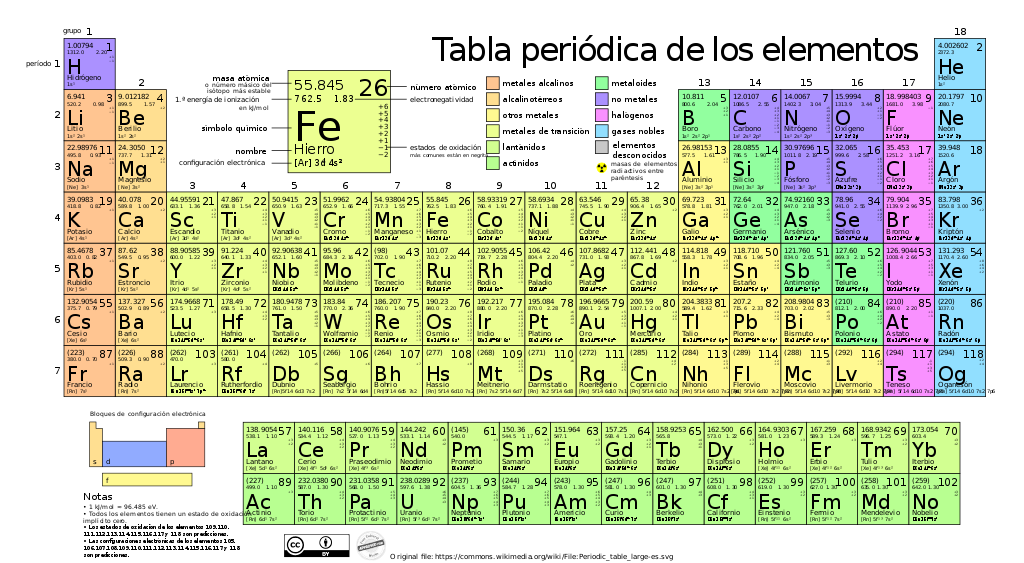
- Metales alcalinos, habitantes de la primera columna, todos altamente reactivos.
- Metales alcalinotérreos, menos reactivos que los anteriores.
- Metales de transición, los que conocemos “de toda la vida”, incluyendo el hierro, níquel, oro, platino… Todos se parecen mucho entre sí, atómicamente hablando.
- Los halógenos son gases muy reactivos, especialmente con los elementos de la primera columna.
- Los gases nobles, en la última columna de la tabla, que son completamente inertes.
- En la isla de los lantánidos y los actínidos, al sur de la tabla periódica, encontramos los elementos radiactivos. La mayoría se desconocían en tiempos de Mendeleev y, en realidad, deberían ubicarse entre los alcalinotérreos y los metales de transición. Los separamos para que la tabla no quede demasiado apaisada.
- Y luego está el cajón de sastre de los metales, metaloides, gases y no metales que viven entre los de transición y los halógenos. A esta categoría pertenecen también los elementos más recientes, nombrados en 2016 como nihonio, moscovio, téneso y oganesón.
Ochenta años después de la publicación de la tabla periódica de Mendeleev, por fin entendimos los electrones. O, mejor dicho, por fin alguien entendió los electrones.
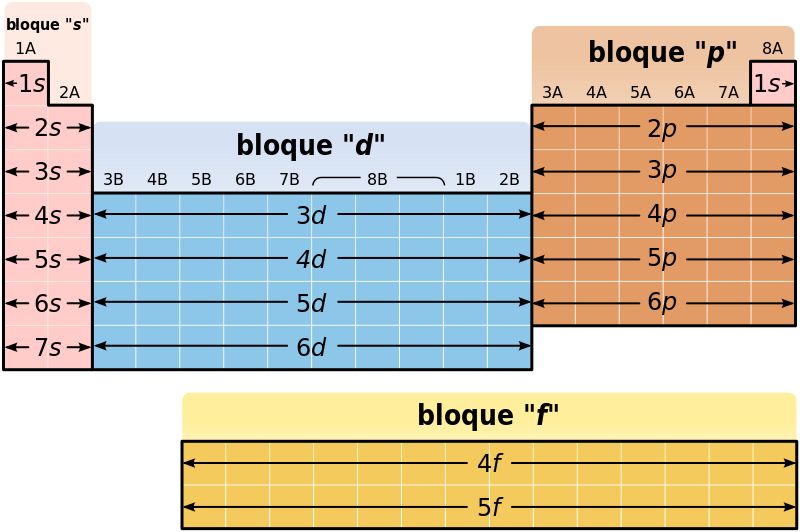
Un átomo está compuesto de distintas partículas: protones y neutrones que conforman el núcleo y electrones que orbitan alrededor. La suma de protones y neutrones del núcleo es lo que denominamos número másico. Este número es precisamente el que sirve para ordenar los elementos de la tabla periódica. En química cuántica, los orbitales moleculares describen el comportamiento de los electrones cuando ondulan en una molécula alrededor del núcleo. Se conocen 19 configuraciones orbitales diferentes: desde el 1s (o lo que es lo mismo, 1 solo electrón, como el hidrógeno) al 7f que pueden alcanzar las estructuras más complejas.
Sabiendo lo que sabemos hoy en día sobre las cargas de los átomos, nos damos cuenta de que la tabla periódica de Mendeleev ordena los elementos según el tipo de orbital en la capa de valencia, los electrones que interactúan con otros átomos:
Dmitri Mendeleev nunca recibió el premio Nobel pero, por supuesto, el genio ruso tiene su propio elemento: el número 101 o Mendelevio, descubierto en 1955 por un grupo de investigación de la Universidad de California en Berkeley. También se ha dado su nombre a un cráter de la Luna. Y no es para menos.
Igual que Jean-François Champollion estudió la piedra de Rosetta para descifrar los jeroglíficos del Antiguo Egipto, Mendeleev elaboró el procedimiento científico que se sigue utilizando para descifrar los átomos y entender su funcionamiento.