La proteína ACE2 podría alertar de la gravedad del covid-19
Javier Sáez Valero, Universidad Miguel Hernández
En unos pocos meses todos nos hemos convertido en “expertos” del covid-19. Así, manejamos con soltura términos como PCR e, incluso, entendemos cómo unos ciclos bajos de amplificación de estos test indican que existe una carga viral alta (hay tanto virus que amplificando muy pocos ciclos lo detectamos).
Tampoco nos es ajeno que las personas afectadas por el SARS-CoV-2 puedan tener una carga viral alta pero presentar poca sintomatología. Y, por supuesto, todos sabemos la gran cantidad de sujetos que resultan infectados pero son asintomáticos, incluso con carga viral alta.
Con todo ello, la PCR se posiciona como una técnica diagnóstica precisa y fundamental para detectar rápidamente a los positivos de infección. Esta rápida determinación permite cortar el ciclo de contagios y propagación de la enfermedad.
Sin embargo, la PCR no informa sobre la gravedad de la patología y la potencial progresión de la misma. Por eso, se hizo necesario encontrar un biomarcador que permitiese anticipar si un enfermo tenía peor previsión, si requería más vigilancia y que nos informase de la respuesta a los tratamientos que se aplicarían.
La proteína ACE2, un posible nuevo biomarcador
Actualmente se está intentando obtener más información sobre la gravedad de la enfermedad a partir de la proteína ACE2, la responsable de que el SARS-CoV-2 penetre en nuestras células.
Se trata de una glicoproteína que se encuentra distribuida de manera abundante en nuestro organismo, en nuestras membranas celulares. Particularmente, en la mucosa oral y nasal y en el epitelio del pulmón, lo que proporciona posibles vías de entrada para el coronavirus.
El tracto gastrointestinal, los riñones, el corazón, las glándulas suprarrenales, el cerebro y los testículos son ejemplos de tejidos extrapulmonares con expresión de ACE2 confirmada e invasión por SARS-CoV-2.
Esta proteína se dispone atravesando la membrana. De esta forma, expone la mayor parte de su estructura hacia fuera de la célula. Esto hace que pueda funcionar como receptora e interaccionar con otras proteínas o ligandos.
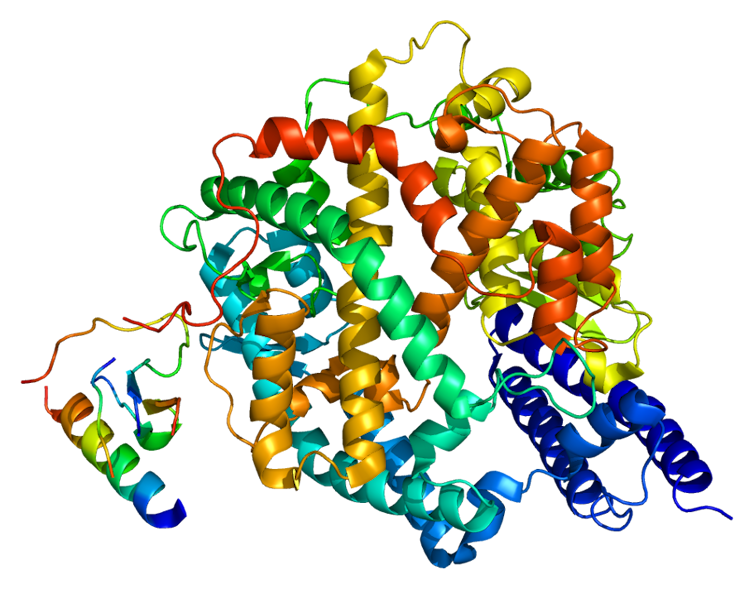
Ya conocíamos que las proteínas receptoras de este tipo, al interaccionar con ligandos (para translocar una señal al interior celular), se cortan. Por eso, pensamos que este proceso debía ocurrir también al interaccionar con el virus, pues existen evidencias que apuntan en este sentido.
Además, por otro lado, en fluidos como el líquido cefalorraquídeo o plasma ya habíamos caracterizado varias de estas proteínas de membrana en su forma completa. Es decir, estaban solubles sin corte previo que las fragmentara de la membrana.
Con este conocimiento previo y la potencial diversidad de formas ACE2 solubles, perseguimos la idea de determinar dichas formas en el plasma de pacientes con covid-19: tanto las formas completas como las formas “cortadas ” podrían aumentar o disminuir.
ACE2 en el plasma de pacientes covid-19
En nuestro estudio vimos todas esas formas de ACE2 presentes en plasma humano, lo que nos permitió corroborar que la situación era altamente compleja: observamos dos formas que identificamos como fragmentos, pero también varias formas completas de ACE2, probablemente originadas en distintos tejidos.
Pero los resultados fueron aún más interesantes al observarlos en pacientes de covid-19: todas las formas de ACE2 completas mostraron tendencia a disminuir en el plasma, mientras que solo uno de los dos fragmentos de la enzima (es decir, de los “rotos”), el de menor tamaño, mostró un comportamiento distinto, con tendencia a aumentar.
Por eso, interpretamos que cuando este fragmento concreto aumentaba, reflejaba la interacción de esta proteína con el SARS-CoV-2, ya que debía originarse tras dicha unión, por fragmentación de la proteína completa.
Eso provocaría que tengamos menos proteína ACE2 completa a costa de la generación del fragmento pequeño. Cuando consideramos uno respecto al otro para cada individuo, es decir, fragmento de ACE2 respecto a forma completa, las diferencias entre afectados y no afectados se agrandan. Esto nos permite también distinguir enfermos de covid-19 de otros con patologías pulmonares como la gripe A.
Proteína ACE2 antes y después de pasar el coronavirus
Las mayores diferencias las encontramos entre muestras del mismo paciente, cuando se comparaban plasmas obtenidos en fases de infección y tras superar la covid-19. Observamos que a los dos meses, y ya superada la enfermedad, los recuperados mostraban también recuperación de los niveles de la ACE2 completa en su plasma, mientras que los fragmentos habían disminuido.
Otros laboratorios en el mundo han examinado también ACE2 en el plasma de enfermos de covid-19, la mayoría por técnicas modernas que permiten obtener resultados reproducibles y fiables de gran número de muestras de manera simultánea, como el ELISA (del inglés Enzyme-Linked ImmunoSorbent Assay); otros trabajos han realizado la determinación de la actividad enzimática de ACE2.
Pero estas técnicas no permiten discriminar entre formas de ACE2 si no se hace una separación previa de fragmentos. Así, los resultados obtenidos de diversos estudios son difícilmente interpretables en su conjunto.
Un nuevo biomarcador para prever la gravedad de la enfermedad
En la carrera científica para dar soluciones a la grave crisis del SARS-CoV-2 la información que puede proporcionar el análisis de las distintas formas de ACE2 en el plasma puede ser de alto valor pronóstico.
Nuestras investigaciones en proceso indican además su utilidad en ensayos clínicos para saber si una terapia o vacuna es efectiva. Pero toda esta potencialidad del ACE2 como biomarcador del covid-19 requiere un análisis exhaustivo de las distintas formas de ACE2, completas y fragmentos.
Por ello, antes que lanzarse al diseño de plataformas que permitan un rápido análisis, sin saber qué formas de ACE2 medimos y por tanto de qué informan, debemos avanzar en la investigación básica de esta proteína.
Un correcto estudio será la base para el diseño de kits de fácil y rápida aplicación, pero lo más importante, de utilidad clínica. Ese es nuestro empeño.
Javier Sáez Valero, Catedrático de Bioquímica y Biología Molecular de la Universidad Miguel Hernández de Elche. Investigador Principal del Instituto de Neurociencias UMH-CSIC, del CIBER en Enfermedades Neurodegenerativas y del Instituto de investigación sanitaria ISABIAL, Universidad Miguel Hernández
Este artículo fue publicado originalmente en The Conversation. Lea el original.