Cuatro estudios pioneros sobre el dolor crónico
El dolor es una señal de alarma frente a un daño posible. Pero el dolor crónico, sin utilidad como mecanismo de alerta o defensa, es un acuciante problema médico que afecta a cerca del 20% de la población española y a más de un 30% a nivel mundial. Es más común en mujeres y en personas mayores de 65 años. Para abordar este problema y reducir su impacto social, desde la Universidad Miguel Hernández (UMH) de Elche, cuatro grupos de investigación realizan estudios pioneros sobre el dolor crónico. En el Día Mundial del Dolor que se celebra hoy, 17 de octubre, las científicas y científicos de la UMH presentan sus líneas de investigación para entender los cambios que se dan en la transición de dolor agudo a dolor crónico y encontrar nuevas terapias.
Desde 2004, promovido por la Asociación Internacional para el Estudio del Dolor (IASP) y la Organización Mundial de la Salud (OMS), cada 17 de octubre se celebra el Día Mundial del Dolor. Esta efeméride tiene como objetivo sensibilizar a la sociedad sobre la necesidad urgente de reforzar la investigación para evitar o reducir el sufrimiento físico y emocional de los 770 millones de personas que sufren dolor crónico. Uno de los principales escollos en su tratamiento deriva del hecho de que sus causas son diversas, como por ejemplo lesiones en nervios, enfermedades víricas o tratamientos del cáncer, entre otras. Por tanto, es necesario encontrar distintas aproximaciones terapéuticas, dependiendo del origen del dolor.
Desde el Instituto de Neurociencias, centro mixto de la UMH y el Consejo Superior de Investigaciones Científicas ubicado en el campus de Sant Joan d’Alacant, y el Instituto de Investigación y Desarrollo e Innovación en Biotecnología Sanitaria (IDiBE) en el campus de Elche, varios grupos de investigación trabajan para entender las causas de la generación del dolor y desarrollar nuevas terapias para mitigar el impacto social de esta patología incapacitante.
Entender los circuitos del dolor
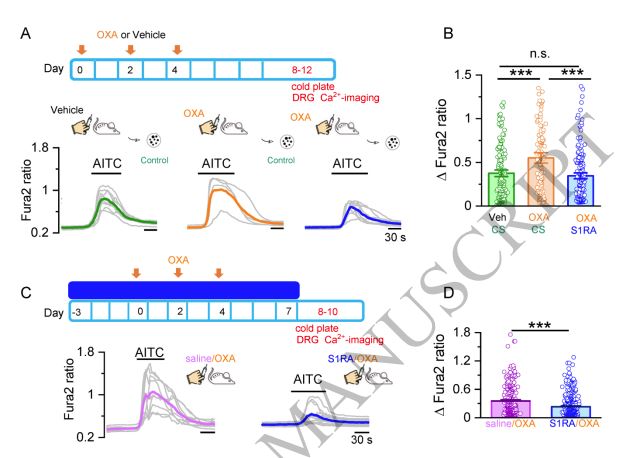
El Grupo de Transducción Sensorial y Nocicepción del Instituto de Neurociencias, dirigido por el investigador Félix Viana y las investigadoras Ana Gomis y Elvira de la Peña, estudia las neuronas especializadas en detectar estímulos térmicos y mecánicos, así como los circuitos espinales responsables de procesar estas señales. Para ello, utilizan diferentes modelos experimentales de patologías dolorosas como dolor postquirúrgico, el daño por compresión nerviosa o el asociado a la quimioterapia. Recientemente, han logrado prevenir el dolor neuropático de la quimioterapia del cáncer de colon en ratones. Han descubierto que los efectos secundarios del tratamiento con oxaliplatino, que provoca hipersensibilidad al frío y al tacto, pueden evitarse con un antagonista del receptor del dolor conocido como TRPA1.
El ojo como modelo para entender el dolor neuropático
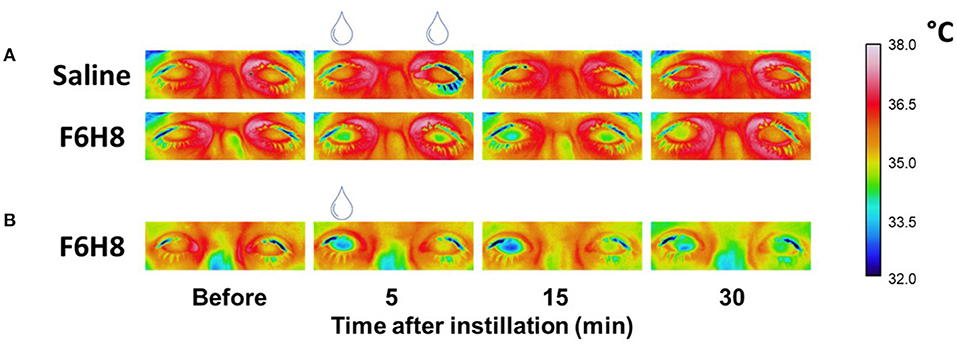
Por su parte, el grupo de investigación en Neurobiología Ocular, también del Instituto de Neurociencias, dirigido por las investigadoras Juana Gallar y Mª Carmen Acosta y por el investigador Víctor Meseguer, centra su estudio en el dolor y otras sensaciones anómalas en el ojo, especialmente las derivadas de la cirugía ocular y de la sequedad ocular crónica. Además de estudiar los mecanismos moleculares y celulares que provocan el dolor neuropático en los ojos, buscan mejorar la calidad de vida de las personas con dolor ocular crónico mediante el desarrollo nuevas herramientas de diagnóstico y nuevos tratamientos que favorezcan la regeneración de los nervios lesionados y mitiguen el dolor. Estos tratamientos están basados en tecnologías novedosas como el uso de fármacos que se activan e inactivan con luz de un determinado color. También, tratamientos que impiden que se activen los genes que controlan los receptores neuronales del dolor como el TRPV1, actualmente en ensayo clínico fase III, previa a la comercialización.
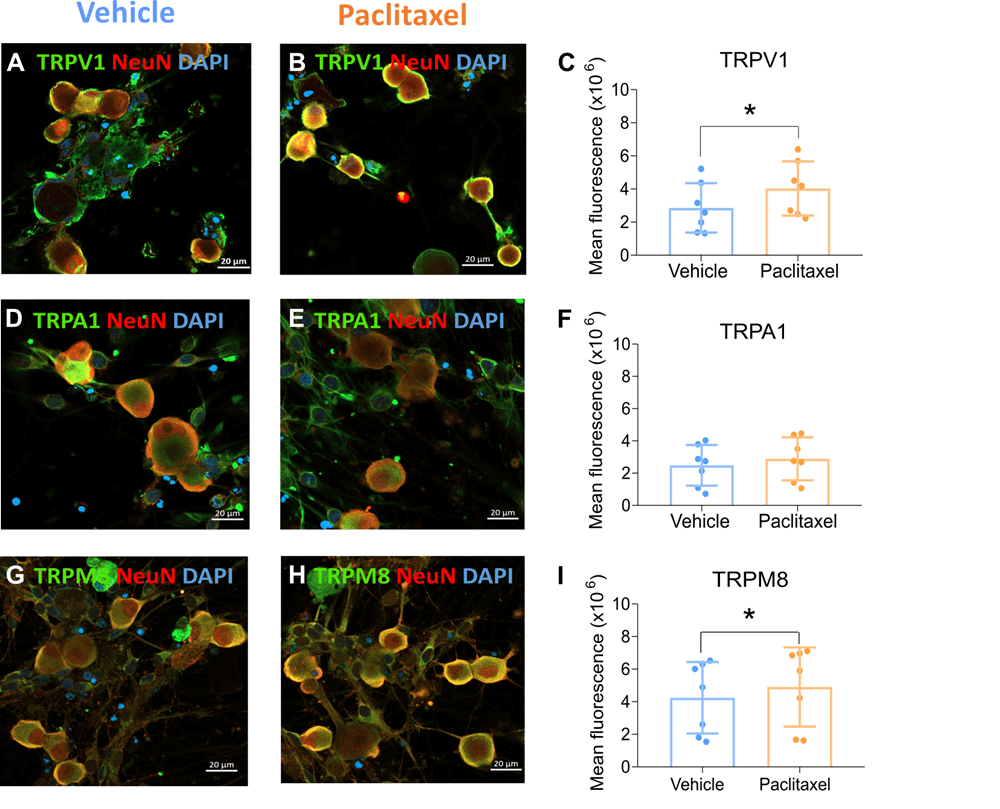
El grupo de Neurobiología Sensorial del IDiBE, liderado por los investigadores Gregorio Fernández y Antonio Ferrer y la investigadora Asia Fernández, centra su trabajo en comprender las bases moleculares del dimorfismo sexual presente en la migraña, que es 3 veces más prevalente en mujeres que en hombres, y en la neuropatía periférica por quimioterapia. El objetivo a medio o largo plazo es el desarrollo de nuevas terapias que mejoren la calidad de vida de los pacientes, restableciendo el normal funcionamiento del sistema sensorial cutáneo. La investigación en migraña crónica ha señalado a los receptores sensoriales del picante (el mencionado TRPA1) y del frío o mentol (TRPM8) como causantes de los episodios migrañosos. Por otro lado, han descubierto que los receptores sensoriales de la temperatura TRPV1 se vuelven más activos en pacientes con neuropatía por quimioterapia, un efecto secundario de algunos tratamientos del cáncer que provoca una elevada sensibilidad térmica y mecánica en las manos y los pies que puede hacerse crónica hasta en el 30% de los pacientes tratados. Su trabajo ha resultado en el desarrollo de una crema de aplicación tópica (Oncapsisens) que atenúa las molestias sensoriales palmoplantares que sufren los pacientes de cáncer que desarrollan neuropatía por la quimioterapia. Este producto se dispuso en las farmacias a principios de 2022.
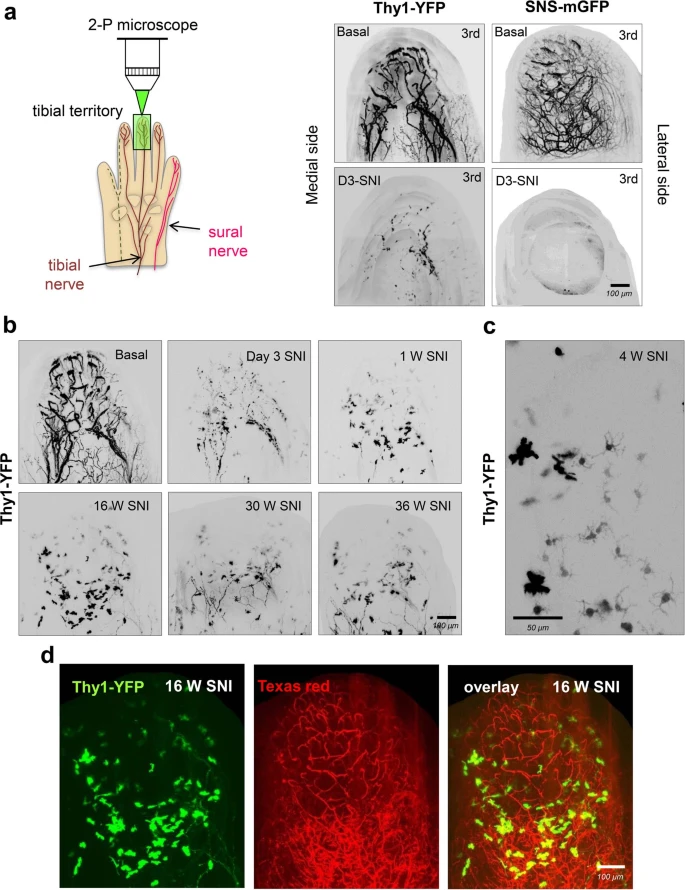
Finalmente, en el Instituto de Neurociencias, el Grupo de Conectividad y Función de Circuitos Somatosensoriales, liderado por el investigador Francisco J. Taberner, estudia los cambios asociados a la cronificación del dolor. Recientemente, han descubierto un nuevo mecanismo por el cual, tras sufrir un traumatismo que afecte a los nervios, las fibras del dolor colonizan estructuras del tacto, con lo que incrementa la sensibilidad en la transmisión del dolor. También, investigan los cambios que ocurren en los circuitos neuronales de la médula espinal durante el proceso de cronificación del dolor. Quieren identificar y obtener las proteínas clave de las neuronas de la médula espinal que regulan la transmisión de dolor. Este conocimiento detallado lo utilizarán para llevar hasta estas neuronas clave unas moléculas que se activan con luz infrarroja y, así, controlar la transmisión del dolor de forma no invasiva y con mínimos efectos secundarios.